2024年,那些被药监局单独“点名”的创新药(附名单)_风闻
医药热点-作为医药大健康账号,可提供准确有价值的行业信息。21分钟前
根据中国国家药监局(NMPA)官网批件信息及公开资料统计,截至12月31日,在2024年所有获批上市的新药中,药监局以单独公告的方式,宣布了34款新药获批,覆盖糖尿病、宫颈癌、乳腺癌、非小细胞肺癌、黑色素瘤等多个疾病领域。
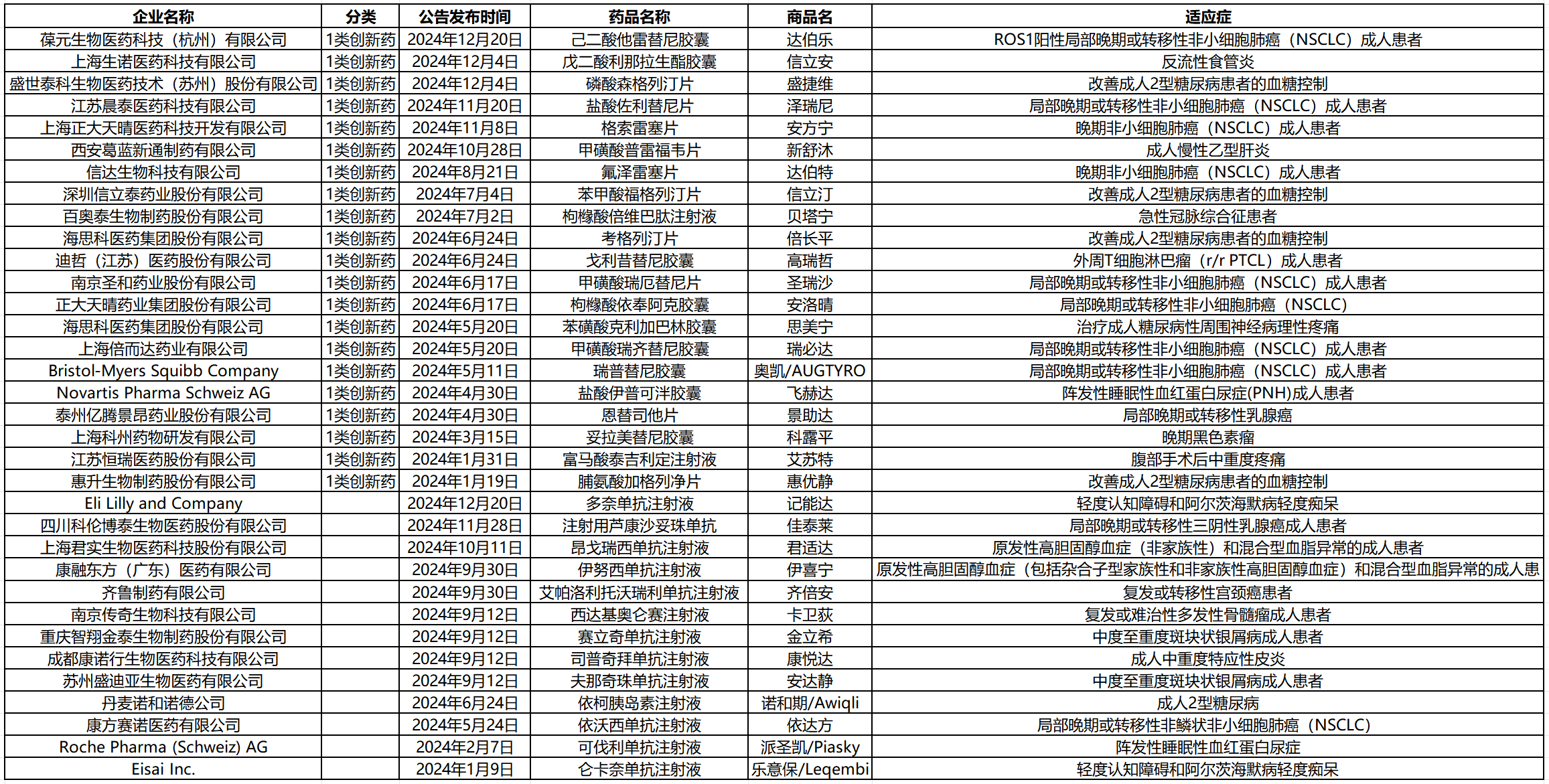
对34款新药进行梳理后,我们发现1类创新药数量最多,共21款,占比高达61.8%。其中虽有来自国际药企的药品,如诺华的“飞赫达”,但大部分来自中国医药企业,如恒瑞医药的“艾苏特”、海思科的“思美宁”、正大天晴的“安方宁”等。
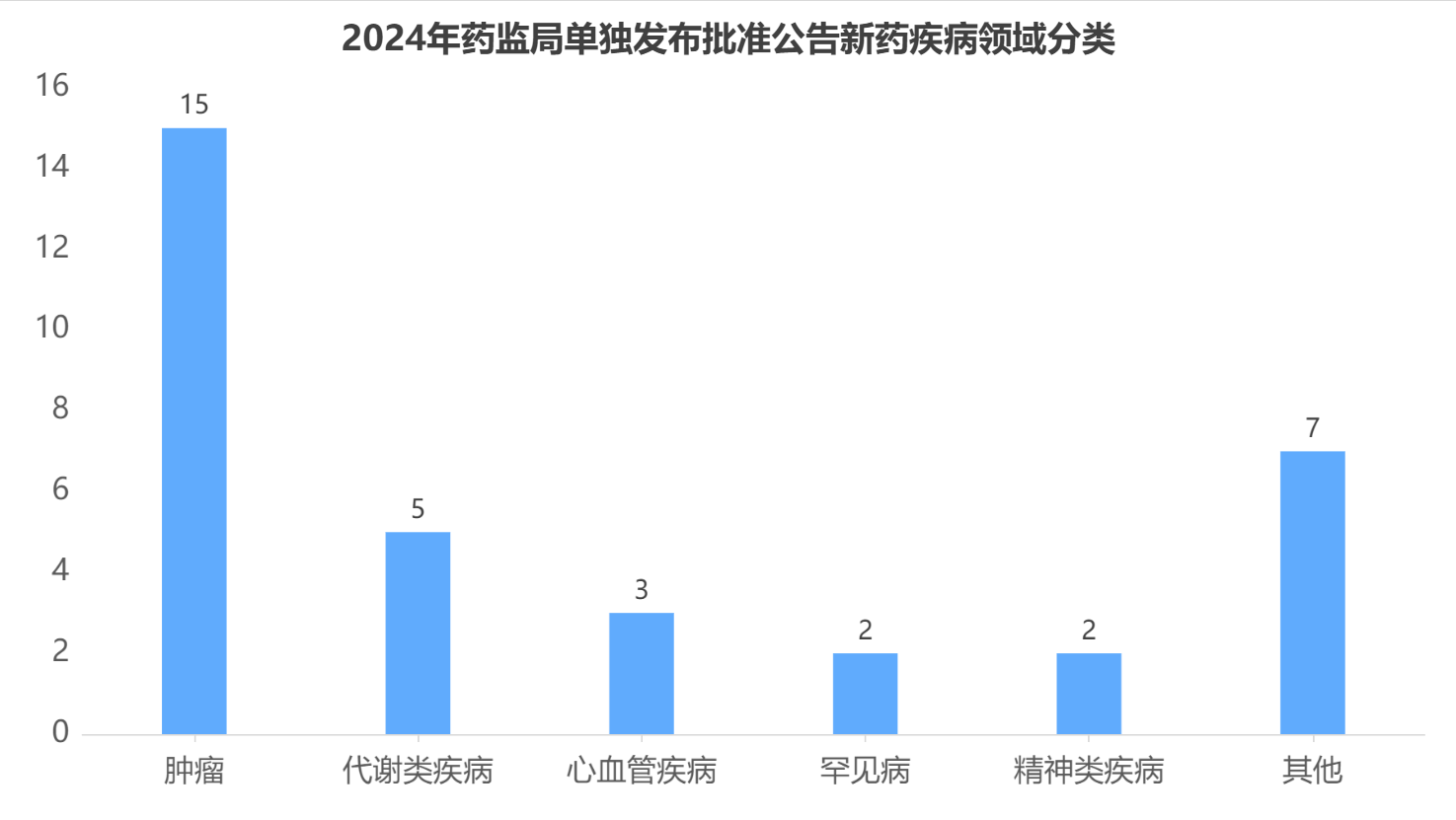
从适应症来看,在34款经药监局单独发布药品批准公告的新药中,抗肿瘤适应症的药品最多,占比约为44%,其中以肺癌、乳腺癌为主;其次是针对2型糖尿病的代谢类疾病药物,占比为14%左右;此外针对心血管疾病、罕见病的治疗药物也均有获批。
其中,不乏社会及业内均高度关注的创新药:
仑卡奈单抗注射液(商品名:乐意保/Leqembi)&多奈单抗注射液(商品名:记能达)
在2024年的年初和年尾,两款治疗AD(阿尔茨海默病)的新药仑卡奈单抗注射液(商品名:乐意保/Leqembi)&多奈单抗注射液(商品名:记能达)相继获批,将人们的注意力再次拉回到了这个曾长期没有创新药问世的疾病领域。
1月9日,国家药品监督管理局通过优先审评审批程序批准Eisai Inc.申报的仑卡奈单抗注射液(商品名:乐意保/Leqembi)上市,用于治疗由阿尔茨海默病引起的轻度认知障碍和阿尔茨海默病轻度痴呆。据悉,仑卡奈单抗是近20年来美国FDA首个完全批准的阿尔茨海默症新药,2023年7月在美国获得完全批准,2023年9月在日本获得批准,中国是继美国和日本之后第三个上市仑卡奈单抗的国家。
12月20日,国家药品监督管理局批准Eli Lilly and Company(礼来)申报的多奈单抗注射液(商品名:记能达)上市,与仑卡奈单抗注射液都同样用于治疗由阿尔茨海默病引起的轻度认知障碍和阿尔茨海默病轻度痴呆。
两款药物都是靶向阿尔茨海默病领域经典的Aβ(β-淀粉样蛋白)靶点,通过减少或是清除Aβ沉淀,来减缓疾病进展,其中据礼来透露,多奈单抗注射液是目前唯一一个有证据支持在清除淀粉样蛋白斑块后可停药的靶向淀粉样蛋白的疗法。
华山医院神经内科主任医师郁金泰教授在接受采访时说到:“AD 靶向精准治疗新药的临床使用只是一个开始,随着基础研究理论突破、精准诊断和靶向药物研发的不断深入,这一领域充满无限可能,AD 将来完全有希望成为一种能被攻克的疾病。”
依沃西单抗注射液(商品名:依达方)
5月24日,国家药品监督管理局通过优先审评审批程序批准康方赛诺医药有限公司申报的依沃西单抗注射液(商品名:依达方)上市。11月28日,康方生物宣布依达方®(依沃西单抗注射液,PD-1/VEGF双抗)已经被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2024年)》(“国家医保目录”,自2025年1月1日起正式执行)。
该药联合培美曲塞和卡铂,用于经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗后进展的EGFR基因突变阳性的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者的治疗。
康方生物创始人、董事长、总裁兼首席执行官夏瑜博士曾表示,依沃西成功被纳入国家医保目录,体现了国家对依沃西创新价值和临床价值的高度认可,也体现了国家对中国创新药物发展的支持和培育,进一步坚定了康方生物走源头创新发展道路的信心。“依沃西是中国独立自主研发的创新生物药物,具有优异的临床价值。该药物被纳入国家医保目录,将有效地提高药物的可及性,显著地降低患者用药负担,让更多患者从全球领先的药物中获益,这践行了康方生物以科技创新造福广大人民群众的企业发展理念。”夏瑜博士道。
氟泽雷塞片(商品名:达伯特)
8月21日,国家药品监督管理局通过优先审评审批程序附条件批准信达生物科技有限公司申报的1类创新药氟泽雷塞片(商品名:达伯特)上市,这是国内首个获批的KRAS G12C抑制剂,也是信达生物的第十一款产品,将惠及KRAS G12C突变的肺癌患者。
肺癌是中国第一大恶性肿瘤。根据中国国家癌症中心与国际肿瘤研究机构(IARC)联合测算,2022年,国内新增肺癌患者达106.1万例,其中非小细胞肺癌约占肺癌总数的80%~85%,是最常见的肺癌类型。Kirsten大鼠肉瘤病毒癌基因同源物(KRAS)突变是一种重要的致癌驱动基因,常见于胰腺癌、结直肠癌、非小细胞肺癌等多种癌症中。中国非小细胞肺癌患者KRAS G12C突变率约为3%,年新发病例为2.7万。然而由于KRAS靶点的“不可成药性”,全球范围内可用药物很少,治疗选择有限,过去40年里国内始终未开发出针对性治疗方案,中国该群体患者的二线治疗仍以化疗为主,存在巨大的未满足临床需求。
达伯特(氟泽雷塞片)的上市,填补了国内KRAS G12C突变靶向治疗的空白,更以其快速缓解、疗效持久、突破血脑屏障强效对抗脑内肿瘤、耐受性良好等的特点,为患者提供了显著的生存期延长和生活质量提升的可能。
司普奇拜单抗注射液(商品名:康悦达)
9月12日,国家药品监督管理局批准成都康诺行生物医药科技有限公司申报的司普奇拜单抗注射液(商品名:康悦达)上市,用于治疗外用药控制不佳或不适合外用药治疗的成人中重度特应性皮炎。作为国内首个、全球范围第二个申报并获批上市的IL-4Rα抗体药物,该药的上市,填补了国产特应性皮炎生物制剂领域的空白。
特应性皮炎(Atopic Dermatitis)是一种慢性复发性炎症性疾病,近年来发病率持续上升,是疾病负担最重的皮肤病。其病程持续时间长,累及各年龄段人群,中重度患者比例近30%。尽管近年来特应性皮炎治疗取得了显著进展,但现有治疗方案尚无法完全满足患者对皮损改善和治疗达标的要求,因此,探索能够实现更高治疗目标、满足长期规范管理需求的治疗方案,对于缓解和控制病情、提高患者生活质量具有重要意义。
北京大学人民医院皮肤科主任张建中教授表示:”司普奇拜单抗开出中国首张处方,正式进入临床应用,这在国内特应性皮炎治疗领域具有里程碑意义,不仅填补了国产中重度特应性皮炎治疗用生物制剂的空白,实现了国产创新药的突破,而且为患者带来‘同类最优’、达到EASI-90治疗目标的新方案,为医生和患者带来了安全有效的治疗新选择。”
昂戈瑞西单抗注射液(商品名:君适达)
10月11日,国家药品监督管理局批准上海君实生物医药科技股份有限公司申报的昂戈瑞西单抗注射液(商品名:君适达)上市。昂戈瑞西单抗注射液是君实生物自主研发的注射用重组人源化抗PCSK9单克隆抗体,君实生物也是国内首家获得该靶点药物临床试验批件的中国企业。
《中国血脂管理指南(2023年)》指出,心血管疾病是我国城乡居民第一位死因,其中以动脉粥样硬化性心血管疾病(ASCVD)为主。低密度脂蛋白胆固醇(LDL-C)水平升高是ASCVD的致病性危险因素,通过降低LDL-C水平可显著减少ASCVD的发病及死亡危险。昂戈瑞西单抗注射液就适用于在控制饮食的基础上,与他汀类药物、或者与他汀类药物和依折麦布联合用药,用于在接受中等剂量或中等剂量以上他汀类药物治疗,仍无法达到低密度脂蛋白胆固醇(LDL-C)目标的原发性高胆固醇血症(非家族性)和混合型血脂异常的成人患者。
中南大学湘雅二医院赵水平教授表示:“昂戈瑞西单抗正式获批是个令人振奋的消息,这将为他汀类等药物降脂效果不佳的原发性高胆固醇血症和混合型高脂血症患者提供一种全新的治疗选择,为了兼顾患者给药的易用性和便利性,除通过PFS给药外,还开发了AI给药方式,可省去由医护人员进行注射给药的过程,以实现居家给药等可能增加患者便利性的用药场景。结果显示,无论昂戈瑞西单抗PFS还是AI给药,昂戈瑞西单抗均表现出相当的显著降脂作用,希望其能够尽快到达患者手中早日惠及更多患者。”
除了上述新药外,2024年还有其他多款新药在中国获批上市,详情可见中国国家药监局(NMPA)官网及官方新闻稿。